Alkali, çözünen metal hidroksitleri ve özellikle alkali metallerin hidroksitleridir. Alkali terimi çoğu zaman çözeltisi baz özelliği gösteren (asitleri nötralleştire, turnusolu maviye çeviren) maddeler için de kullanılır. Örneğin, sodyum karbonatın çözeltisi baz özelliği gösterdiğinden alkali olarak nitelendirilir. Amonyak da alkali sınıfına girer.
Alkali Metaller
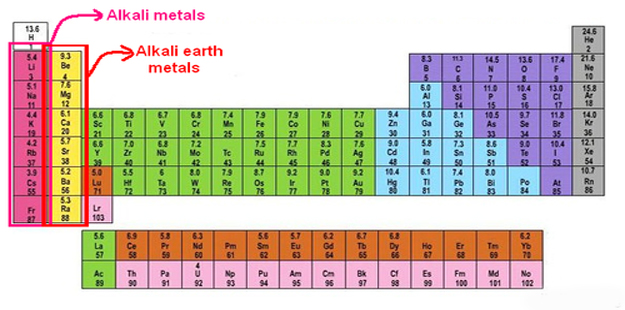
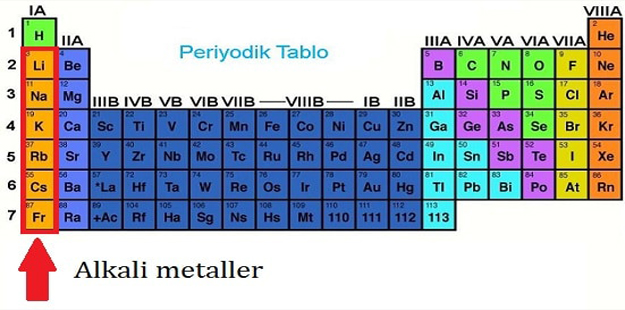
Periyodik çizelgenin 1A grubunu oluşturan elementler (tablo aşağıdadır). Bu metaller, lityum (Li), sodyum (Na), potasyum (K), rubidyum (Rb), sezyum (Cs), ve fransiyum (Fr)’dur. Fransiyum radyoaktif bir elementtir ve yanlanma süresinin kısalığı nedeniyle (223Fr için 21 dakika) doğada bulunmaz. Alkali metaller gümüş beyazı renginde taze kesilmiş yüzeyleri metal parlaklığı gösteren, bir bıçakla kolaylıkla kesilebilecek kadar yumuşak elementlerdir. Lityum, sodyum ve potasyumun yoğunlukları sudan büyüktür. Grupta atom numarasının artmasıyla birlikte iyon yarıçapı ve yoğunluğu artar; buna karşılık erime noktası ve elektronegatiflik azalır. Yerkabuğunda lityum % 0,003, sodyum % 2,63, potasyum % 2,40, rubidyum % 0.0035 ve sezyum da % 0,0007 oranında bulunur. Buna göre, sodyum ve potasyum yerkabuğunda bol bulunan elementler arasındadır. Alkali metaller bileşiklerinde her zaman +1 yükseltgenme basamağında bulunurlar. Kimyasal bakımdan çok etkin olduklarından doğada serbest olarak bulunamazlar. Ametallerle doğrudan doğruya ve şiddetle tepkimeye girerek hidrojen çıkarırlar. Bu tepkimenin yavaş ve sakin olması nedeniyle laboratuvarlarda alkali metal artıklarının yokedilmesi için etil alkol kullanılır. Alkali melaller oksijenle birleşerek çeşitli oksitleri oluştururlar. Normal oksitler (M20)i suyla patlarcasına şiddetli bir biçimde birleşerek hidroksitleri oluştururlar. Sarı renkli peroksitlerin sulu çözeltileri metal hidroksit ile lıidrojen peroksidin çözeltilerinin karışımı gibi davranır. Süperoksitler (MO2) turuncu renklidirler. Alkali metallerin peroksit ve süperoksitleri çok kuvvetli yükseltgen özellik gösterirler. Havanın oksijeni ve neminden hızla etkilenen alkali metaller, petrol eteri altında saklanırlar. Üstleri donuk görünümlüdür. Taze kesilmiş yüzeyleri metalik parlaklık gösterir, fakat hızla donuklaşır. Alkali metaller Mx formülünde halojenürler (X=F,CI, Br, 1) MOH formülünde hidroksitler, M2S04 formülünde sülfatlar, M2NO3 formülünde nitratlar ve M2S formülünde sülfürler oluştururlar. Alkali metal sülfürleri suda kolaylıkla çözünürler ve hidroliz nedeniyle sulu çözeltileri kuvvetli bazik özellik gösterir. Amonyum iyonunun (NH4+) yarıçapı, potasyum ile rubidyumun iyon yarıçapları arasında yer alır. Bu nedenle, çözünme özellikleri bakımından amonyum tuzları alkali metal tuzlarına benzerler. Alkali metaller çok aktif (elektropozitif) olmaları nedeniyle elementel biçime kolaylıkla indirgenemezler. Serbest elementlerin elde edilmesi erimiş klorürlerinin elektrolizi yoluyla yapılır.
Toprak Alkali Metaller
Periyodik çizelgeni IA grubunda yer alan altı element: Kalsiyum (Ca), stronsiyum (Sr), magnezyum (Mg), berilyum (Be), baryum (Ba), radyum (Ra). Bu elementlere toprak alkalileri denmesinin nedeni, oksitlerine eskiden toprak denmesinden ileri gelir. Çok belirgin metal niteliği taşırlar. Bu elementler iki değerli, elektropozitif ve alkalilerden daha az indirgeyicidirler. Oksijen içinde kolayca yanarak yükseltgenirler ve oksitleri suyla tepkimeye girerek hidroksitleri oluştururlar.
 Alkali Metallerin Özellikleri
Alkali Metallerin Özellikleri
Alkali metaller, periyodik tablonun IA Grubunda bulunan elementlerdir. Alkali metaller, lityum, sodyum, potasyum, rubidyum, sezyum ve franciumdur.
Alkali metallerin, yoğunlukları diğer metallerin yoğunluğundan daha düşüktür. Ancak alkali metaller, metallerde bulunan fiziksel özelliklerin birçoğunu sergilerler. Alkali metallerin dış kabuklarında gevşekçe bağlanmış bir elektron bulunur. Böylelikle periyodik cetveldeki yerlerine göre en büyük atom yarıçaplarına sahip olurlar. Düşük iyonlaşma enerjileri metalik özellikleri ve yüksek reaktiviteleri ile sonuçlanır. Bir alkali metal, tek değerlikli katyonu oluşturmak için değerlik elektronunu kolayca kaybedebilir. Alkali metallerin elektronegatiflikleri düşüktür. Ametallerle, özellikle halojenlerle kolayca reaksiyona girerler.
Ortak Özelliklerin Özeti
– Diğer metallerden daha düşük yoğunluktadırlar
– Bir gevşek bağlı değerlik elektronuna sahiptirler
– En büyük atom yarıçapına sahiptirler
– Düşük iyonlaşma enerjileri vardır
– Düşük elektronegatiflik
– Yüksek reaktiftirler. Kolay etkileşime girerler.